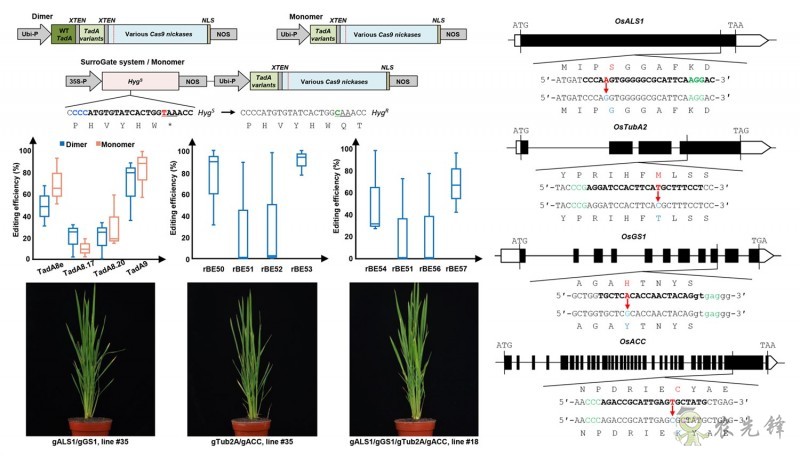
据周焕斌研究员介绍,近年来,由CRISPR系统(CRISPR1.0)与核苷酸脱氨酶为基本架构的植物碱基编辑器(CRISPR2.0),作为一种重要技术手段在植物学基础研究和作物品种改良中得到了广泛应用。相对于胞嘧啶碱基编辑器的深度优化,目前已有的腺嘌呤碱基编辑器基本采用腺嘌呤脱氨酶突变体TadA7.10,编辑效果差强人意,不少基因组靶位点的编辑效率都较低,甚至为零,严重限制了该技术在植物学和作物品种改良中的应用。
为了实现对现有植物腺嘌呤碱基编辑器的优化升级,该团队研究人员对用腺嘌呤脱氨酶突变体衍生版本进行了评估,并在此基础之上开发出全新版本TadA9。进一步采取TadA单体策略以及整合SurroGate系统,多个测试靶位点处的碱基编辑效率逐步提高至90%以上,基本类似于CRISPR技术进行靶基因敲除的表现。TadA9扩大了编辑窗口范围,尤其是对于之前难以编辑的靶位点表现出强劲的编辑能力。该研究还证实,TadA9能与众多Cas9衍生蛋白和同源蛋白广泛兼容。利用TadA9载体,该团队成功对水稻主栽品种南粳46中的4个除草剂靶标基因实现了一次性同时改造,4个靶点共编辑效率高达 56.25%,其中3个靶基因的编辑效率高于80%。该研究优化出的一系列高效腺嘌呤碱基编辑器极大地扩展了单碱基编辑技术在植物上的应用,对植物功能基因组学研究和农作物分子精准育种改良具有重大推进作用。
该研究得到了中国农科院科技创新工程、基地平台提质增效技术创新任务、国家转基因科技计划、国家自然科学基金等项目支持。相关技术已申请国家发明专利并获授权。